寫意報告丨醫療3D打印技術 505(b)(2)路徑下產品開發的新機遇與技術挑戰
隨著增材制造技術的飛速發展,醫療3D打印已從概念探索步入商業化應用深水區。在這一進程中,美國FDA的505(b)(2)新藥申請路徑,為基于已有獲批產品的改良型醫療器械與藥物-器械組合產品開發,開辟了一條極具潛力的創新通道。本報告旨在探討3D打印技術如何與505(b)(2)路徑深度融合,為醫療產品開發帶來結構性新機遇,并剖析其背后的關鍵技術開發方向。
一、 505(b)(2)路徑:嫁接已知與未知的創新橋梁
505(b)(2)路徑允許申辦方依靠并非由自身開展的研究數據,來支持其新藥或組合產品的安全性與有效性。其核心在于對已獲批產品(“參考產品”)進行改良,例如改變劑型、劑量、給藥途徑,或增加新適應癥、開發復方制劑等。對于醫療3D打印領域,這一路徑的價值尤為凸顯:
1. 降低開發風險與成本:無需從零開始進行全面的臨床前與臨床研究,可大幅縮短開發周期,加速產品上市。
2. 聚焦高價值改良:企業可將資源集中于利用3D打印技術實現的關鍵性能提升,如個性化匹配、復雜結構制造、控釋給藥等。
3. 拓展產品生命周期:為成熟的“老藥”或經典器械植入物賦予新的技術內涵與市場競爭力。
二、 3D打印技術驅動的505(b)(2)產品新機遇
結合3D打印的技術特性,在505(b)(2)框架下,以下幾類產品開發迎來爆發性機遇:
1. 個性化植入物與手術導板
機遇:基于患者CT/MRI數據,打印完全貼合解剖結構的顱頜面骨板、脊柱融合器、關節植入物等。這屬于對已獲批標準化植入物的“給藥途徑/使用方式”的深度個性化改良。
技術開發焦點:生物力學優化算法、醫用級金屬(鈦合金、鉭)與高分子(PEEK)材料的打印工藝驗證、術后長期隨訪數據的積累以證明個性化設計的優越性。
2. 復雜結構的藥物洗脫器械
機遇:制造傳統工藝無法實現的、具有復雜多孔或網格結構的藥物洗脫支架、骨填充物或軟組織修復膜。通過精準控制孔隙率和結構,優化藥物的負載與釋放動力學。
技術開發焦點:藥物與可打印生物材料的相容性、打印過程對藥物活性的影響、體外釋放與體內藥代/藥效的橋接研究。
3. 個性化劑型與給藥裝置
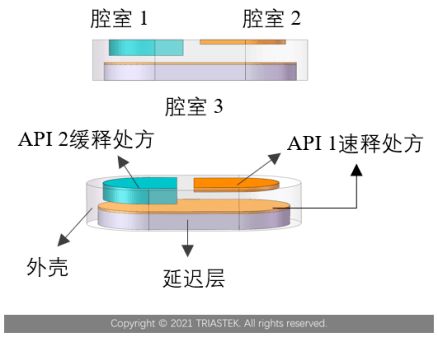
機遇:打印具備特定形狀、大小、內部結構和多藥物分區的口服片劑(多單元遞送系統),或定制化的皮下植入物、宮內器械等。這是對劑型、劑量和釋放行為的革命性改變。
技術開發焦點:適用于熔融沉積成型(FDM)或立體光固化(SLA)的藥用輔料開發、打印工藝的過程分析技術(PAT)與質量控制、體內外相關性(IVIVC)研究模型的建立。
4. 組織工程支架與先進治療產品(ATMPs)
機遇:打印承載細胞或生長因子的生物活性支架,用于軟骨、皮膚等組織再生。這類產品可能介于器械、生物制品與組合產品之間,505(b)(2)路徑可借鑒已有生物材料或生長因子的安全數據。
技術開發焦點:生物墨水的開發與標準化、打印后細胞活力與功能維持、規模化生產的無菌保證。
三、 關鍵技術開發挑戰與應對策略
盡管機遇巨大,但技術開發路徑上布滿挑戰,需要系統性攻關:
1. 材料科學與法規
醫用3D打印材料(特別是聚合物和復合材料)的長期生物相容性、降解行為、滅菌穩定性數據尚不完善。開發需與USP Class VI等生物相容性標準以及材料化學、制造與控制(CMC)要求緊密結合。
2. 工藝驗證與質量保證
3D打印是一個逐層構建的過程,工藝參數(如層厚、溫度、掃描路徑)對產品關鍵質量屬性(CQA)影響巨大。必須建立從數字模型到最終產品的全過程驗證體系,并實施嚴格的批次間一致性控制。
3. 設計工具與軟件認證
用于生成打印文件的醫學圖像處理與設計軟件,其算法可靠性直接影響患者安全。這類軟件作為醫療設備的一部分,其開發流程需符合醫療器械軟件(SaMD)的監管要求。
4. 臨床證據生成策略
在505(b)(2)路徑下,需要科學論證3D打印改良相較于參考產品的“相似性”與“優越性”。這要求設計巧妙的臨床終點,可能包括解剖匹配度、手術時間、患者特異性功能恢復等,而非傳統的統一樣本統計。
四、 結論與展望
醫療3D打印與505(b)(2)監管路徑的結合,正催生一個以“精準”和“個性化”為核心的醫療產品開發新范式。成功的關鍵在于跨學科深度融合——工程師、材料學家、藥理學家和臨床醫生必須與法規事務專家早期協作,共同定義產品屬性和開發策略。
隨著材料數據庫的擴充、打印工藝的標準化、以及監管科學對個性化產品評價體系的逐步完善,基于3D打印的505(b)(2)產品有望從當前的骨科、齒科,快速拓展至心血管、神經、腫瘤治療等多個高價值領域,最終實現從“批量生產”到“精準創造”的醫療制造革命。企業若能率先攻克上述技術開發難關,并嫻熟運用505(b)(2)策略,必將在這場變革中占據制高點。
如若轉載,請注明出處:http://www.gdhuadi.cn/product/58.html
更新時間:2026-02-14 03:09:31